Về việc WHO không chấp nhận kit của VietACorp, thông tin từ Bộ Y tế chiều nay 20.12, cho biết: “WHO đưa ra danh sách EUL về một số sản phẩm để các đơn vị của WHO tham khảo và mua sắm khẩn cấp phục vụ phòng chống dịch, chứ không liên quan đến chất lượng hay tiêu chuẩn cấp phép”.
Theo một thông báo của Tổ chức Y tế thế giới (WHO) vào tháng 10.2020, bộ kit test Covid-19 đầu tiên của Việt Nam do Công ty CP công nghệ Việt Á sản xuất không được WHO công nhận.
Không đạt tiêu chuẩn của WHO
Cụ thể, thông báo công khai của WHO như sau: sản phẩm LightPower iVA SARS-CoV-2 Bộ RT-PCR có mã số EUL 0524-210-00 không được chấp nhận. Đây là sản phẩm của Công ty CP công nghệ Việt Á (VietACorp), có địa chỉ tại số 372A/8 Hồ Văn Huê, P.9, Q.Phú Nhuận, TP.HCM.
“Sản phẩm do Việt Nam sản xuất, không đủ điều kiện để mua sắm của WHO”, WHO nêu rõ.
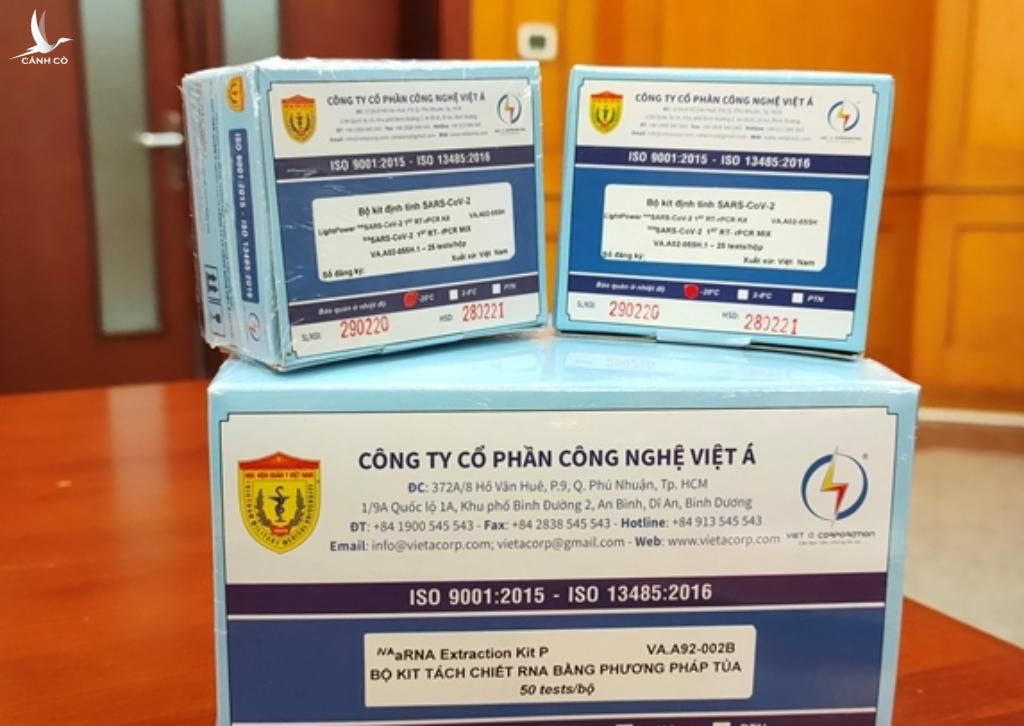
Nguyên nhân, theo WHO, VietACorp được yêu cầu cung cấp thông tin cập nhật về tình trạng của hệ thống quản lý chất lượng. Sau khi xem xét tài liệu được đệ trình, WHO hỗ trợ đánh giá về Hệ thống quản lý chất lượng của nhà sản xuất. Kết quả, thông tin được cung cấp không phải là bằng chứng đầy đủ về việc tuân thủ tiêu chuẩn ISO 13485:2016.
ISO 13458:2016 là tiêu chuẩn đã được chấp nhận và được áp dụng rộng rãi cho các nhà sản xuất thiết bị y tế trên toàn thế giới, và là một yêu cầu cần phải có nếu như một tổ chức sản xuất thiết bị y tế muốn sản phẩm của mình được công nhận rộng rãi trên thế giới. Phiên bản ISO 13458:2016 của WHO là “Hướng dẫn về Yêu cầu nộp hồ sơ: Chẩn đoán trong ống nghiệm (IVD) Phát hiện Axit nucleic SARS-CoV-2, PQDx_ 347”.

Về quy trình EUL (đánh giá sử dụng khẩn cấp) trong thông báo ở trên, WHO đưa ra nhằm thúc đẩy sự sẵn có của các thiết bị y tế in vitro (trong ống nghiệm) cần cho các tình huống khẩn cấp về sức khỏe, để hỗ trợ thông tin cho các cơ quan mua sắm và các nước thành viên Liên Hiệp Quốc.
Trang thiết bị y tế chẩn đoán in vitro gồm thuốc thử, chất hiệu chuẩn, vật liệu kiểm soát, dụng cụ, máy, thiết bị hoặc hệ thống được sử dụng riêng rẽ hoặc kết hợp theo chỉ định của chủ sở hữu để phục vụ cho việc kiểm tra các mẫu vật có nguồn gốc từ cơ thể người.
Trên cơ sở đánh giá sử dụng khẩn cấp, các quốc gia có thể quyết định phê duyệt, sử dụng các sản phẩm cụ thể đã được chấp thuận trong bối cảnh khẩn cấp về y tế, dựa trên dữ liệu về chất lượng, an toàn và hiệu quả đã được thẩm định.
Bộ Y tế nói gì?
Về việc WHO không chấp nhận kit của VietACorp, thông tin từ Bộ Y tế chiều nay 20.12, cho biết: “WHO đưa ra danh sách EUL về một số sản phẩm để các đơn vị của WHO tham khảo và mua sắm khẩn cấp phục vụ phòng chống dịch, chứ không liên quan đến chất lượng hay tiêu chuẩn cấp phép”.
Theo Bộ Y tế, sản xuất trang thiết bị y tế trong nước, bao gồm kit test chẩn đoán từ ngày 1.1.2020, phải đạt tiêu chuẩn ISO 13485. Theo đó, VietACorp đã đạt tiêu chuẩn này khi sản xuất kit test xét nghiệm Covid-19.
Như vậy, có thể thấy, sản phẩm kit test của Công ty CP công nghệ Việt Á đạt tiêu chuẩn trong nước nhưng không đạt tiêu chuẩn và được WHO chấp nhận. Trong khi đó, liên quan đến sản phẩm kit test này, vào thời điểm tháng 4.2020, có rất nhiều thông tin từ các cơ quan chức năng khẳng định WHO chấp thuận được sử dụng rộng rãi. Trong đó, trang web của Bộ KH-CN nhiều lần đưa tin WHO đã chấp nhận, tuy nhiên đến nay tất cả đã không còn truy cập được.
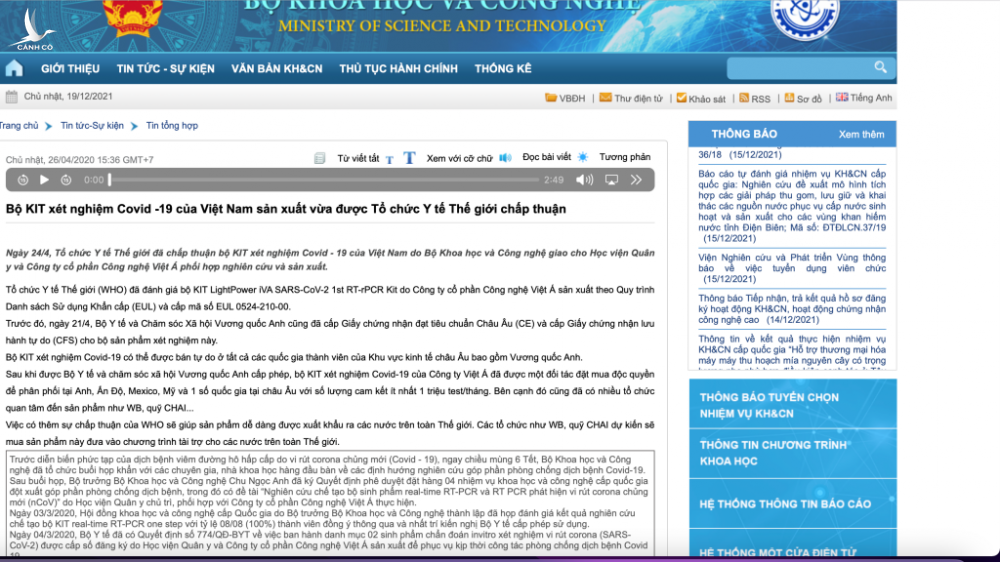
Trước đó, ông Phan Quốc Việt (41 tuổi), Tổng giám đốc VietACorp, cùng nhiều thuộc cấp đã bị Bộ Công an khởi tố, điều tra về hành vi “thổi giá” kit xét nghiệm Covid-19.
VietACorp quảng cáo đây là bộ kit chẩn đoán SARS-CoV-2 đầu tiên tại Việt Nam, được Bộ Y tế cấp số đăng ký; Bộ Y tế và Chăm sóc xã hội Anh cấp giấy chứng nhận đạt tiêu chuẩn châu Âu (CE), cấp giấy chứng nhận lưu hành tự do (CFS); WHO cấp chứng nhận chất lượng sản phẩm cho phép lưu hành toàn cầu.
Cũng theo quảng bá, năng lực sản xuất của Công ty CP công nghệ Việt Á khoảng 30.000 kit xét nghiệm/ngày. Bộ kit xét nghiệm này cho kết quả chính xác 100% sau 2 giờ và đáp ứng được các tiêu chí tương đương các bộ sinh phẩm do CDC Mỹ và WHO hướng dẫn.
Tiên Phong
Theo: Cánh cò


